
Developing Detection Tools
|
|
內容簡介
癌症患者在接受化療期間往往會出現不同程度的副作用,這是因為這些藥物會導致一種特殊的細胞死亡—— 細胞焦亡 (Pyroptosis)。與細胞凋亡 (Apoptosis) 不同,細胞焦亡會引起嚴重發炎反應,因此又稱為發炎性細胞死亡。中國科學院院士邵峰博士及其研究團隊發現,降低或剔除 Gasdermin E (GSDME) 蛋白質表現量,可以減緩甚至完全避免化療藥物副作用 [1]。 邵院士在研究中使用了靈敏度極高的抗體,該抗體是由邵院士目前所任職的北京生命科學研究所 (NIBS) 與 Abcam 共同合作開發,能檢測到極微量的 GSDME 蛋白 [2]。他預估,如果沒有此訂製抗體,他的研究團隊將會多花 6 個月時間才能順利發表研究成果到 Nature 雜誌。他的研究成果不僅增進了科學家對細胞死亡和腫瘤的認知,也提供了改善化療效果的可能性,以及一種新型的癌症診斷和預後判斷標靶 — GSDME。 以下是 GEN (Genetic Engineering & Biotechnology News, 基因工程與生物技術新聞) 雜誌與邵峰院士的訪談內容翻譯 [3]。 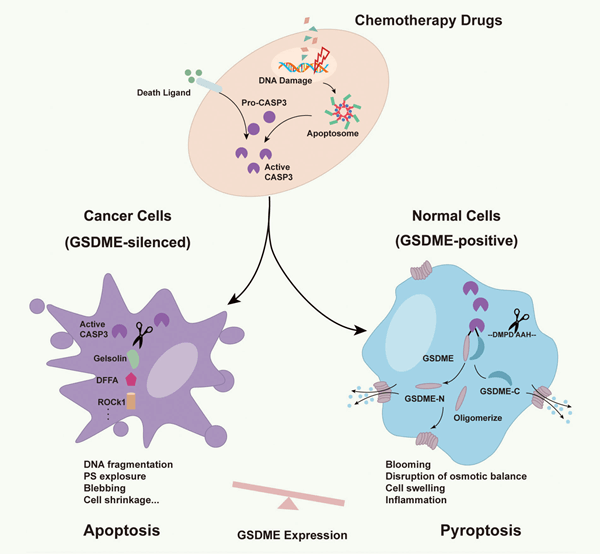
接受化療藥物的癌症患者往往會產生各種不良副作用,例如組織損傷、免疫力下降和體重減輕。降低這些副作用可以改善患者的生活品質,並且可能提高治療成功率。隨著對化療毒性的深入了解,科學家最新聚焦於 Gasdermin,它是一種常見於上皮細胞、造血細胞、和許多其他具有免疫防禦功能的組織中的蛋白質家族。已發現一些 Gasdermin 家族成員 (包括知之甚少的 Gasdermin E (GSDME)) 直接參與了癌症和腫瘤抑制。 根據最近的研究,GSDME 能夠將化療藥物引發的細胞凋亡反應迅速扭轉為細胞焦亡,這種由細胞凋亡轉向細胞焦亡的變化,帶出了兩個有趣的問題:
為了回答這些問題,開發合適且可重複的檢測工具是絕對必要的。 長久以來,細胞焦亡一直被認為僅是由 Caspase-1 活化主導的單核球細胞死亡方式,其主要用來反應對抗細菌侵襲。我們現在知道,細胞焦亡實際上是經由 “發炎體 (inflammasome)” 活化 Caspase-1、或是經由革蘭氏陰性菌的脂多醣體 (lipopolysaccharide, LPS) 活化 Caspase-4/5/11,所引發的一種細胞程序性死亡,為先天性免疫防禦機制。由於 Gasdermin D (GSDMD) 可被 Caspase-1/4/5/11 切割活化後參與細胞焦亡反應,因此被視為是 Caspase-1/4/5/11 引發細胞焦亡反應的最終劊子手。此外,最近的一項研究發現,GSDME 可被 Caspase-3 切割活化,進而導致細胞焦亡。這些機制的發現,讓我們將細胞焦亡的概念重新定義為由 Gasdermin 家族蛋白參與誘發的程序性細胞壞死。它們改變了我們對程序性細胞死亡的基本理解。 為了透過動物或細胞模式,研究降低 GSDME 表現量是否能夠減緩或避免由化療藥物所引發的細胞焦亡及其發炎反應,北京生命科學研究所 (NIBS) 的研究人員與 Abcam 的科學家共同合作開發了 GSDME 抗體。 具體而言,這些研究人員開發了高靈敏度和高專一性的重組兔源單株抗體,使用了 RabMAb® 專利技術,可專一性辨識人類和小鼠 GSDME 的 N-末端結構、或 C-末端結構。 所開發的檢測抗體之所以必須能夠清楚區分 GSDME N-末端結構與 C-末端結構,是因為 Caspase-3 切割 GSDME 後,唯有 GSDME-N 片段具有在細胞膜打孔的活性,並最終導致細胞焦亡。這些抗體使得研究人員能夠精確地分析癌細胞、內源細胞以及組織中的 GSDME 蛋白質表現量。 動物模式和細胞模式的研究結果證實,化療藥物透過 GSDME 引發細胞焦亡,並且該過程是造成患者在化療時出現副作用的部分原因。這是因為 GSDME 的存在使得細胞能夠藉由 Caspase-3 切割活化 GSDME 產生具有細胞膜打孔活性的 GSDME N-片段,並迅速將原本的細胞凋亡方式扭轉為細胞焦亡。這種由 GSDME 誘發的細胞焦亡是化療藥物產生廣泛性發炎損傷與毒副作用的主要關鍵。 腫瘤和正常組織皆能不同程度地表現 GSDME 蛋白。此合作計畫中所共同開發的 GSDME 重組兔源單株抗體,能夠檢測到極微量的 GSDME,有助於鑑別 GSDME 在各種細胞內的表現量,包含正常細胞和 NCI-60,其中 NCI-60 是美國國家癌症研究所用於篩選和評估抗癌藥物的一套癌細胞株組合,涵蓋了 60 種不同人類癌細胞株。 儘管 GSDME 蛋白在大多數類型的癌細胞中均不表現,但該團隊鑑定出了幾種具有 GSDME 高表現量的人類細胞株,包含 SH-SY5Y (神經母細胞瘤細胞) 和 MeWo (皮膚黑色素瘤細胞)。藉由這兩種細胞株,該團隊證明經 GSDME 參與產生的細胞焦亡反應,可透過不同的因子引發,例如腫瘤壞死因子或化療藥物,和/或引起 Caspase-3 活化的 DNA 損傷。這項研究結果顯示,Caspase-3 切割並活化 GSDME,最終導致細胞焦亡。而細胞內的 GSDME 表現量,則決定了在 Caspase-3 活化後,細胞最終表現的程序性細胞死亡類型。使用誘發細胞凋亡的化療藥物治療後,具有 GSDME 高表現量的細胞通常會發生細胞焦亡。 此外,在 SH-SY5Y 和 MeWo 細胞中,化療藥物誘導的細胞焦亡在 zVAD (一種能夠阻止 GSDME 被切割活化的 Caspase 抑製劑) 存在下受到了抑制。當使用人類 GSDME 基因剔除 (GSDME−/−) 的 SH-SY5Y 細胞株時,化療藥物誘導的細胞焦亡沒有發生。同時,發現低表現或不表現 GSDME 的細胞,在細胞凋亡後會發生繼發性細胞壞死。 在腫瘤形成期間,GSDME 通過甲基化修飾使其基因的啟動子區域被甲基化,處於轉錄抑制狀態。這是大多數癌細胞不表現 GSDME 的原因。這引出了一個有趣的可能性,即逆轉這種轉錄抑制是否可能會使這些癌細胞對化療藥物敏感? 為了測試這種可能性,使用 Azacitidine (一種被批准用於治療骨髓增生不良徵候群、骨髓性白血病或慢性骨髓單核細胞白血病的癌症藥物) 治療不表現 GSDME 的細胞。Azacitidine 可抑制甲基轉移酶,逆轉 GSDME 的甲基化/沉默,提高細胞內 GSDME 的表現量,進而增加其他化療藥物對癌細胞的殺傷力。 與癌細胞相反,許多正常細胞高度表現 GSDME,使得正常細胞對於化療藥物特別敏感,容易進入細胞焦亡途徑。傳統化療藥物之所以會產生如此劇烈的細胞毒性,一個主要原因即歸咎於正常組織細胞焦亡所引發的嚴重發炎損傷。 為了測試 GSDME 是否就是化療藥物殺傷正常組織細胞引發藥物副作用的原因,研究人員使用化療藥物 Csplatin 處理 GSDME 基因剔除 (Gsdme−/−) 的小鼠,並觀察其體內臟器 (如小腸、脾臟、肺臟等組織)。此項實驗結果進一步驗證了 GSDME 引發的細胞焦亡導致發炎性損傷的假說。那麼 GSDME 就極有可能在化療藥物引發的毒副作用中扮演著重要的角色。若果真如此,調節 GSDME 的表現量就有可能是改善化療藥物副作用的有效手段。 目前正在研究的目標是了解細胞焦亡途徑是否由 GSDMD 和/或 GSDME 引發,以及下游發炎反應是否有助於腫瘤形成、或在調節腫瘤免疫反應中起作用。目前尚不清楚針對細胞焦亡的免疫療法是否可以改善癌症治療。為了解決這個問題,需要進行更深入的研究。研究人員可以檢驗是否能夠透過細胞激素誘發細胞焦亡,來調控殺死癌細胞。此外,他們可以進一步確認細胞焦亡是否可以調控癌症免疫細胞中檢查點阻斷介質的有效性。 到目前為止所進行的研究改變了我們對於細胞焦亡的理解,並且提供了對程序性細胞死亡的新觀點。此外,還闡明了透過調控 GSDME 表現量可避免化療許多副作用的可能性。GSDME 表現量和發生的細胞死亡類型之間的明顯聯繫,也意味著以抗體為基礎的 GSDME 表現量檢測,可作為一種新的癌症診斷和預後判斷工具。
參考文獻與資料
以上文章翻譯自 GEN 雜誌,圖片為原文版權所有。
|
 |
 中國科學院院士 邵峰 博士
中國科學院院士 邵峰 博士