|
新品推薦 | HTRF Human C1q Binding Kit 協助您精確檢測單株抗體藥物的 C1q 結合能力
自 1986 年美國食品藥物管理局 (FDA) 審核通過第一個單株抗體藥物以來,目前已有近 100 種單株抗體藥物取得美國 FDA 許可應用於癌症、發炎性疾病與微生物傳染病等多種人類疾病的臨床治療 [1],同時估計每年約有 40 種新的單株抗體藥物進入臨床測試階段 [2],顯示單株抗體藥物產業正快速蓬勃地發展。
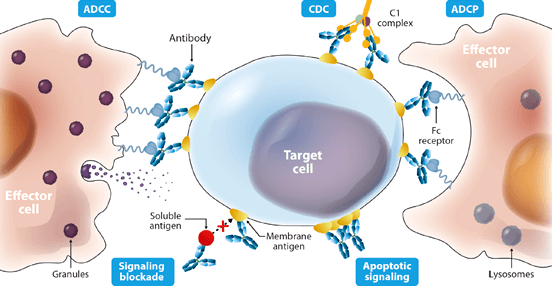
圖 1﹑單株抗體藥物可經由多種機制發揮治療效果,包含:❍ 使用抗體作為其他藥物的傳輸系統,以將藥物運送至目標細胞或特定標靶分子上;❍ 透過抗體與抗原的結合,發揮中和作用 (neutralization) 或是直接引發細胞凋亡 (apoptosis);❍ 抗體與細胞表面抗原結合後,透過抗體 Fc 區域與效應細胞 (effector cells) 或補體 (complement) 的結合產生“效應功能”殺死目標細胞或招聚其他免疫細胞產生次級免疫反應。由單株抗體藥物 Fc 區域所引發的效應功能可區分為:(i) 與自然殺手細胞 (natural killer cells, NK cells) 表面受體 FcγR 結合後所引發的抗體依賴性細胞毒殺作用 (antibody-dependent cell cytotoxicity, ADCC)、(ii) 與巨噬細胞 (macrophages) 表面受體 FcγR 結合後所引發的抗體依賴性細胞吞噬作用 (antibody-dependent cellular phagocytosis, ADCP),以及 (iii) 與補體 C1q 結合後所引發的補體依賴性細胞毒殺作用 (complement-dependent cytotoxicity, CDC) [3-6]。 IMAGE © Front Immunol. 2018 Jan 4;8:1751. Figure 2 [6]. 單株抗體藥物一般為 IgG 抗體 [2],可透過多種機制發揮治療效果,其中很重要的一種就是由抗體 Fc 區域與效應細胞 (effector cells) 或補體 (complement) 結合所引發的效應功能,例如:抗體依賴性細胞毒殺作用 (antibody-dependent cell cytotoxicity, ADCC) 和補體依賴性細胞毒殺作用 (complement-dependent cytotoxicity, CDC) 等(詳見圖 1 說明)[3-6]。使用生物工程技術改造抗體 Fc 區域,以增強或減弱單株抗體藥物引發特定效應功能的能力,是進行單株抗體新藥開發時,提高藥物效能與安全性的常用策略之一 [2, 3, 6, 7]。 針對單株抗體藥物與其改造變體的活性篩選與效應功能分析,過去我們曾經介紹過 ADCC 檢測試劑,在這篇文章中我們將介紹 Cisbio (part of Revvity) 最新研發的 CDC 檢測試劑—— HTRF Human C1q Binding Kit。HTRF Human C1q Binding Kit 採用 HTRF® 技術原理,具有簡易的全均質化實驗流程以及靈敏穩定的偵測效能,能夠讓您節省藥物測試用量、更快完成單株抗體藥物的 C1q 結合活性分析,精確篩選出進行後續 CDC 細胞毒殺實驗驗證的候選藥物。
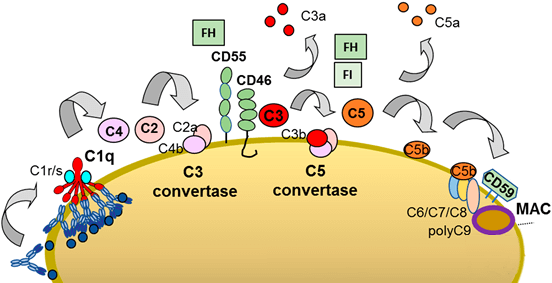
圖 2﹑補體依賴性細胞毒殺作用 (complement-dependent cytotoxicity, CDC)。單株抗體藥物結合於目標細胞後,抗體 Fc 區域與補體 C1q 的結合將會啟動補體活化的經典路徑 (classical pathway)。在經過一連串的補體活化反應後,由補體 C5b, 6, 7, 8, 9 所組成的膜攻擊複合體 (membrane attack complex, MAC) 會在細胞膜上打洞,最終導致目標細胞破裂死亡 [3, 5, 7]。 IMAGE © Antibodies (Basel). 2020 Oct 28;9(4):58. Figure 1 (top) [5].
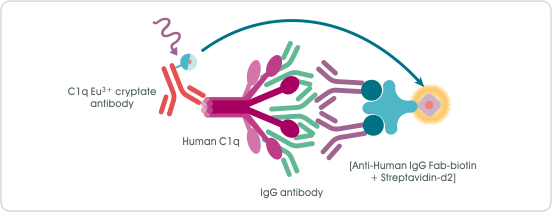
檢測原理(圖 3) 先將標定有 Biotin 的人類 IgG Fab 抗體和標定有受體螢光 d2 的 Streptavidin 混合,使其形成複合物 “Anti-Human IgG Fab-biotin + Streptavidin-d2”,以捕獲反應溶液中的人類單株抗體藥物 (IgG antibody);人類補體 C1q (Human C1q) 則會被標定有供體螢光 Eu cryptate 的人類補體 C1q 抗體 (C1q Eu³⁺ cryptate antibody) 所捕獲。若待測單株抗體藥物的 Fc 區域具有 C1q 結合活性,當兩者結合時,供體螢光與受體螢光間的距離也隨即被拉近。在 317 nm 光源激發下,供體螢光所發出的能量 (620 nm) 將可轉移到鄰近的受體螢光,激發其產生 665 nm 螢光訊號,訊號強度會與單株抗體藥物 Fc 區域的 C1q 結合活性成正比。
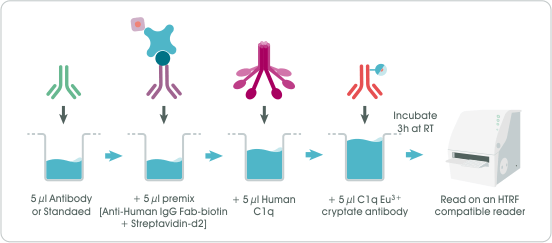
圖 3﹑HTRF Human C1q Binding Kit 檢測原理示意圖。 實驗流程(圖 4) HTRF Human C1q Binding Kit 具有極簡式流程設計,可將實驗操作變異因素降至最低,提升偵測穩定度與結果再現性。操作時,僅需在 96-well 或 384-well 微量多孔盤孔洞中依序加入待測單株抗體藥物(或標準品)、預混合好的複合物 “Anti-Human IgG Fab-biotin + Streptavidin-d2”、人類補體 C1q 以及標定有供體螢光的人類補體 C1q 抗體(總體積 20 µl),於室溫下靜置反應 3 小時即可進行訊號偵測,且訊號可穩定維持 48 小時,讓實驗排程更有彈性。
圖 4﹑HTRF Human C1q Binding Kit 實驗流程示意圖。
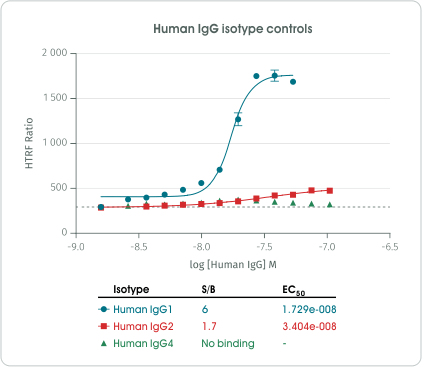
Cisbio 研發團隊首先使用不同亞型的人類 IgG 驗證 HTRF Human C1q Binding Kit 的產品效能(圖 5)。實驗結果與文獻報導相符 [6, 8],人類 IgG1 與 C1q 結合能力較佳、IgG2 則是僅有微弱的 C1q 結合能力,IgG4 完全不會和 C1q 結合。
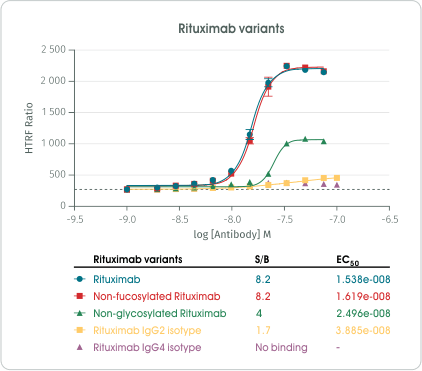
圖 5﹑以不同亞型的人類 IgG 驗證 HTRF Human C1q Binding Kit 產品效能。 接著,Cisbio 研發團隊進一步使用 HTRF Human C1q Binding Kit 檢測單株抗體藥物 Rituximab 多種改造變體的 C1q 結合能力(圖 6)。結果顯示不同改造變體具有不同程度的 C1q 結合能力,其中 IgG4 亞型的 Rituximab 改造變體 (Rituximab IgG4 isotype) 完全失去 C1q 結合能力、IgG2 亞型的 Rituximab 改造變體 (Rituximab IgG2 isotype) 則會失去大部分的 C1q 結合能力、移除 Fc 區域的整個醣鏈 (Non-glycosylated Rituximab) 將造成 Rituximab 對 C1q 結合能力的明顯下降,移除 Fc 區域醣鏈中的岩藻糖 (Non-fucosylated Rituximab) 則不會對 Rituximab 的 C1q 結合能力產生影響。這些結果,皆與文獻研究成果一致 [6, 8-10 ],顯示 HTRF Human C1q Binding Kit 的確能夠精確地檢測出各種單株抗體藥物改造變體的 C1q 結合能力差異。
圖 6﹑以 HTRF Human C1q Binding Kit 檢測單株抗體藥物 Rituximab 多種改造變體的 C1q 結合能力。 在使用 HTRF Human C1q Binding Kit 完成單株抗體藥物的 C1q 結合活性檢測後,建議可以使用 DELFIA® EuTDA Cytotoxicity Reagents 進一步驗證單株抗體藥物引發補體毒殺作用的能力,以篩選出具有潛力的候選藥物。完整產品資訊與技術支援服務,歡迎洽詢 Revvity 台灣代理 — 伯森生技。您可透過下方連結瀏覽更多相關資訊:
References
|
||||

|
 |
|||
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]