|
別讓實驗敗在抗體失效!
這 5 個抗體保存要點你 follow 了嗎?
|
最近有一個實驗室的資深大學長和小編分享了他的辛酸故事。一向自詡實驗小能手的他,這麼多年來不知有多少刁鑽困難的實驗都在他手中一一漂亮地完成了,沒想到上個月竟然陰溝裡翻了船,莫名地在一個 Western Blot 實驗上卡了一週 ?! 更可氣的是,最後發現原因竟然是抗體失效了 !!
原來是新來不久的小學妹錯把應該放在冷凍庫裡的抗體放在了冷藏,還一放就是幾個月,於是抗體很不幸失效了,而毫不知情地從學妹手中接過抗體的學長就這麼被坑了一把…
看來,是時候強調抗體保存的重要性了。
|

|
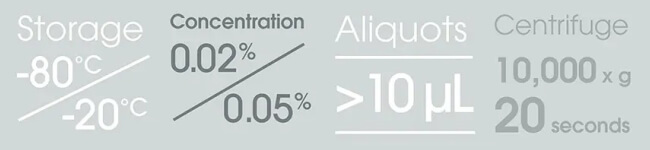
一般來說,收到抗體後,抗體可以在 4°C 下保存 1~2 週。若想長期保存,可以在收到抗體時先以 10,000 x g 的離心力離心 20 秒,排出卡在小瓶螺紋裡的溶液,然後分裝至低蛋白結合的微量離心管中。分裝可以最大程度地減少因反覆凍融 (freeze-thaw)* 造成的損失,還可以避免操作過程中整罐抗體被污染的風險。 ※反覆凍融會使抗體變性,導致抗體形成聚合物,降低抗體的結合能力。
抗體經過分裝後,通常建議保存在 -20°C (在 -80°C 保存並不會增加多少優勢),然而由於抗體特性不一,請務必查看 Datasheet,獲取具體的保存溫度建議。例如,Abcam Carrier-free 無載體 (不含 BSA 和 Azide) 系列抗體有些品項就不能冷凍,只能在 4°C 下保存。
分裝後的抗體應只有經過凍融過程一次,如果在解凍使用後還有剩餘的,則建議在 4°C 下保存,並儘快使用完畢。
分裝量的多少則取決於每次實驗的抗體常規用量,然而建議不要少於 10 μl。因為分裝量太少,就容易受到蒸發影響使濃度遽增,如此一來抗體容易附著在管壁上,造成損失。
|
(2) 避免凍融 (Freeze-thaw) 損失
|
- 儘可能避免使用無霜冰箱保存抗體,因其作用原理容易造成抗體反覆凍融。此外,抗體應存放於冰箱溫度變化最小的區域,例如冰箱內側靠後方後壁處,而非冰箱門處。
- 使用抗凍劑 - 由於甘油 (Glycerol) 可以將冰點降低至 -20°C 以下,因此有些研究人員會在抗體中加入等體積的甘油作為抗凍劑使用,以減少抗體因反覆凍融造成的損失。雖然大部分的情況下這種做法是可行的,然而仍應在實施前先行查閱產品 Datasheet,確認製造商是否有測試過抗體在這種保存條件下的穩定性*。要特別提醒的是,由於 -80°C 低於甘油的冰點,所以不建議在 -80°C 下保存添加有甘油的抗體。此外,考量甘油或其他冷凍保護劑有被細菌污染的可能,務必在使用前對其進行無菌處理。
※若您在 Abcam Datasheet 中無法找到相關資訊,歡迎直接洽詢伯森業務專員。
比起一般未標定抗體,標定抗體在保存上有更多需要注意的地方,例如:無論是螢光標定抗體或是常見的 HRP-, AP- 酵素標定抗體,曝露在光線下都會對其活性造成損傷,因此需要保存在深色瓶內,或是以鋁箔紙包裹。螢光標定抗體還需要特別注意光漂白 (Photobleaching) 的問題,整過實驗過程均應避光操作。更多標定抗體保存建議,請見下方表格說明。
| |
螢光標定抗體 |
酵素標定抗體 |
分裝 |
- 收到抗體後立即進行分裝,整個過程均應避光操作
- 以 10,000 x g 離心力離心 20 秒後,以 Pipette 輕柔抽吸 3~4 次混勻溶液;不要翻轉混和,以免起泡
- 分裝至深色或以鋁箔紙包裹的小瓶內
|
- 收到抗體後立即進行分裝,分裝時避免光線直射
- 以 10,000 x g 離心力離心 20 秒後,以 Pipette 輕柔抽吸 3~4 次混勻溶液;不要翻轉混和,以免起泡
- 分裝至深色或以鋁箔紙包裹的小瓶內
- 不可將疊氮化鈉 (Sodium azide) 加入 HRP 酵素標定抗體,因為這種抑菌防腐劑會抑制 HRP 酵素活性
|
長期保存 |
- 遵循製造商產品說明書指示進行保存
- 如果含有冷凍保護劑 (例如甘油),在 -20°C 下保存,並避免反覆凍融
|
- 遵循製造商產品說明書指示進行保存
- 酵素標定抗體經過凍融後會使酵素活性受損與抗體結合能力降低,因此除非該支酵素標定抗體含有冷凍保護劑,且已通過長期保存於 -20°C 的穩定性測試,否則不建議將酵素標定抗體冷凍保存,應將其保存於 4°C
|
短期保存 |
4°C, 1~2 週 |
|
(4) 使用疊氮化鈉 (Sodium azide) 防止微生物污染
|
為防止微生物污染,您可以在抗體溶液中添加疊氮化鈉 (Sodium azide)(終濃度 0.02%)。 如果抗體已經包含該抑菌防腐劑,您可以在產品 Datasheet 的「儲存緩衝液 (Storage buffer)」部分找到相關說明。
⚠︎ 哪些時候應避免使用疊氮化鈉呢?
- 利用抗體對活細胞進行染色或加藥處理時、或是將抗體用於活體 (in vivo) 研究時,皆應避免使用疊氮化納,因其會阻斷細胞色素 (Cytochrome) 的電子傳遞系統,對生物造成毒性。
- 要對抗體進行標定時,也應避免溶液中含有疊氮化納,因其會干擾胺基 (Amine) 鍵結反應。此時您可以改使用 0.01% 硫柳汞 (Thimerosal) 作為抗體的防腐劑,因其不含一級胺 (Primary amine);或者利用透析 (Dialysis)、超過濾 (Ultrafiltration) 或膠體過濾層析 (Gel filtration) 等方式先行移除抗體溶液中的疊氮化納,待完成標定反應後,再將標定抗體保存於疊氮化鈉中。
- HRP 酵素標定抗體不能使用疊氮化納作為防腐劑,因其會抑制 HRP 酵素活性。
一般來說,蛋白質在較高濃度下比較不容易降解,理想的抗體保存濃度為 ≥1 mg/ml。應避免讓稀釋至工作濃度的抗體於 4°C 儲存超過一天。
如果抗體濃度很低,可以在抗體溶液中添加蛋白穩定劑,例如牛血清白蛋白 (BSA)。蛋白穩定劑可以吸附在管壁上,讓抗體損失降至最低。需特別提醒的是,由於蛋白穩定劑會和抗體競爭,降低結合效率,所以如果您準備要對抗體進行標定,就不要在抗體中添加蛋白穩定劑。
以上就是 Abcam 團隊針對抗體保存整理出的 5 個重點,您可透過下方連結瀏覽更多相關資訊。完整技術支援服務與最新活動訊息,歡迎洽詢 Abcam 台灣代理伯森生技。
|