|
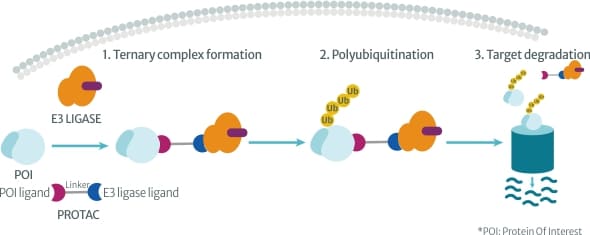
PROTACs 藥物開發應用產品特輯 蛋白水解靶向嵌合體 (proteolysis targeting chimeras, PROTACs) 是混接有兩種不同功能配體 (ligand) 的小分子藥物,其中一個配體能夠與目標蛋白質 (protein of interest, POI) 結合,另一個配體則用來招募 E3 連接酶 (E3 ligase)。藉由 PROTAC 藥物,E3 連接酶將得以靠近目標蛋白質並將其標記上泛素 (ubiquitin);帶有泛素標記的目標蛋白質會被蛋白酶體 (proteasome) 辨識切割降解為小片段胜肽,而 PROTAC 藥物則可以在細胞中循環再利用。
由於 PROTAC 藥物不需要像傳統小分子藥物一般一定要結合在目標蛋白質的活性區域 (active site) 才能發揮作用,而是透過與目標蛋白及 E3 連接酶結合形成“三元複合物 (ternary complex)”的方式驅使細胞利用本身的「泛素-蛋白酶體系統 (ubiquitin–proteasome system, UPS)」將整個目標蛋白質分解,因此對於目前許多無可靶向 (undruggable) 或易引起抗藥性的疾病相關蛋白來說是非常好的新的藥物研發策略。除此之外,PROTACs 標的蛋白降解技術 (targeted protein degradation) 還具有藥效強、毒性低、作用持續時間長、組織穿透力佳以及可製為口服型藥物等多種優勢,近幾年已被積極應用於開發癌症、神經退化性疾病、免疫感染疾病等治療藥物 [1-3]。以下我們就透過實際案例與您分享 HTRF® 與 Alpha® 生物分子檢測技術如何協助科研人員進行 PROTAC 藥物開發與檢測。 | |
以 HTRF® 技術檢測 Linker 長度對 PROTAC 藥物形成三元複合物的效能影響性 |
|
|
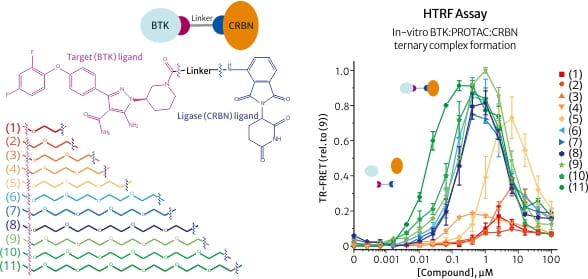
BTK (Bruton's tyrosine kinase, BTK) 蛋白在 B 細胞發育過程中扮演著極為關鍵的角色,目前已知 BTK 的過度活化及表現與多種 B 細胞惡性淋巴瘤疾病相關,例如慢性淋巴球性白血病 (chronic lymphocytic leukemia, CLL)、被套細胞淋巴瘤 (mantle cell lymphoma, MCL) 與瀰漫性大 B 細胞淋巴瘤 (diffuse large B cell lymphoma, DLBCL) 等。臨床上雖然已有能夠抑制 BTK 活性的小分子抑制藥物 Ibrutinib 可以使用,然而卻也面臨到 BTK 突變所導致的抗藥性問題。 為了解決抗藥性患者無藥可用的窘境,輝瑞藥廠 (Pfizer Worldwide R&D) Adelajda Zorba 等人開發出了靶向 BTK 的 PROTAC 藥物;並在此 PROTACT 藥物基礎上,進一步利用 HTRF® 技術分析不同長度的“Linker”(聯結 PROTAC 藥物兩端配體的連接結構)是否會影響到 PROTAC 藥物與目標蛋白質及 E3 連接酶形成三元複合物的效能。
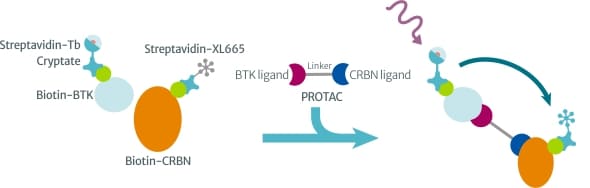
所建立的 HTRF® 檢測平台偵測原理是以標定有 Streptavidin 的供體螢光 Streptavidin-Tb Cryptate 捕獲標定有 Biotin 的 BTK 蛋白、以標定有 Streptavidin 的受體螢光 Streptavidin-XL665 捕獲標定有 Biotin 的 CRBN 蛋白(Cul4 E3 連接酶複合物中負責與受質結合的成員);當 PROTAC 藥物與 BTK 及 CRBN 形成三元複合物時,供體螢光與受體螢光之間的距離即被拉近,於 320 nm 光源激發下,供體螢光所發出的能量 (620 nm) 即可轉移至鄰近的受體螢光,激發其產生 665 nm 螢光訊號。
IMAGE © Proc Natl Acad Sci U S A. 2018 Jul 31;115(31):E7285-E7292. Fig. 1A and 2D [4]. 從 HTRF® 實驗結果來看,在 11 種不同 Linker 長度的 PROTACT 藥物中,擁有較長 Linker的 PROTAC 藥物(藥物編號 6-11)明顯比擁有較短 Linker 的 PROTAC 藥物(藥物編號 1-4)更能有效地形成三元複合物。細胞實驗結果也與 HTRF® 檢測結果一致,編號 6-11 的藥物處理細胞皆可以觀察到明顯的 BTK 蛋白質表現量下降的情形,其中以編號 10 的藥物效果最佳;而編號 1-4 的藥物則無法有效地引發 BTK 降解反應。Adelajda Zorba 等人的研究成果顯示了 Linker 長度對於 PROTAC 藥物優化的重要性 [4]。 |
|
以 AlphaLISA® 技術檢測 PROTAC 藥物對蛋白質異構物的專一性 |
|
|
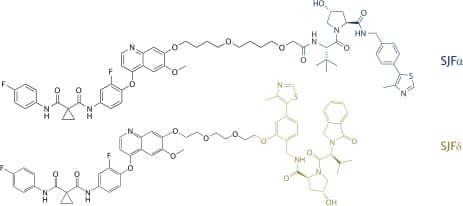
一般 PROTAC 藥物設計多是透過使用不同目標蛋白配體或招募不同 E3 連接酶的方式來調整 PROTAC 藥物的專一性,然而針對結構相似的蛋白質,例如蛋白質異構物 (protein isoforms),耶魯大學 (Yale University) Craig M. Crews 教授研究團隊大膽假設是否有可能在目標蛋白配體與招募的 E3 連接酶不變的前提下,透過修改 PROTAC 藥物 Linker 長度與 E3 連接酶配體結構的方式來調整 PROTAC 藥物的專一性,使其能夠分別作用靶向於不同的蛋白質異構物? 他們挑選的研究對象是與多種人類疾病相關的 p38 MAPK,它具有 4 個家族成員(α, β, γ 與 δ),其中 p38α 已有多項小分子抑制藥物進入臨床試驗階段,p38δ 則因結構因素難以開發出有效的小分子抑制藥物。 Craig M. Crews 團隊設計的 PROTAC 候選藥物皆是以 Foretinib(一種多靶向的激酶活性小分子抑制藥物)作為目標蛋白配體,招募的 E3 連接酶對象皆為 VHL(CRL2 E3 連接酶複合物中負責與受質結合的成員)。他們設計了兩種類型的 E3 連接酶配體好讓 E3 連接酶能夠以不同角度方向與 PROTAC 藥物結合,這兩類 E3 連接酶配體分別是醯胺類 (amide series) 與苯基類 (phenyl series),每種類型又可依據 Linker 長度再細分為 4 種,總共設計合成出 8 種靶向 p38 MAPK 的 PROTAC 候選藥物。
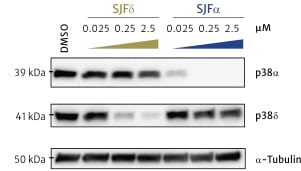
IMAGE © Nat Commun. 2019 Jan 10;10(1):131. Fig. 1d and 1c [5]. 他們將這 8 種 PROTAC 候選藥物以不同濃度處理 MDA-MB-231 人類乳癌細胞,接著使用 WB (western blot) 檢測各 PROTAC 藥物對 p38 異構物的降解效果與專一性。從 WB 實驗結果來看,不同類型的 E3 連接酶配體與 Linker 長度皆會影響到 PROTAC 藥物對 p38 異構物的作用效能與專一性。例如醯胺類的 PROTAC 候選藥物在 Linker 長度僅有 10 或 11 個原子長時沒有作用選擇性,p38α 與 p38δ 的表現量皆會受到 PROTAC 藥物影響而減少;然而當 Linker 長度變為 13 個原子長時,就可觀察到明顯的 p38α 作用專一性(對 p38δ 表現量僅會造成輕微影響 ,對 p38β 與 p38γ 則完全不具影響性),此 p38α 專一性 PROTAC 藥物被命名為「SJFα」。另一方面,苯基類的 PROTAC 候選藥物在 Linker 長度大於 10 個原子時,對各種 p38 異構物皆沒有明顯的降解作用,僅有在 Linker 長度為 10 個原子長時才顯現出明顯的 p38δ 作用專一性(對 p38α、p38β 與 p38γ 皆不具影響性),此 p38δ 專一性 PROTAC 藥物被命名為「SJFδ」。
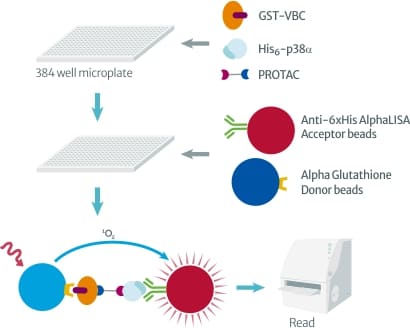
作者進一步使用 AlphaLISA® 技術驗證 PROTAC 藥物“SJFα”對 p38α 的專一性。AlphaLISA® 檢測原理是將 VBC(VHL/Elongin B/Elongin C,E3 連接酶複合物中用來辨識受質蛋白的蛋白質複合體)以 GST-tag 標定,使其能被標定有 Glutathione 的 Alpha 供體微珠 Alpha Glutathione Donor beads 所捕獲;目標蛋白 p38α 則是以 His-tag 標定,使其能被標定有 His-tag 抗體的 Alpha 受體微珠 Anti-6xHis AlphaLISA Acceptor beads 捕獲;當 PROTAC 藥物與 p38α 及 VBC 形成三元複合物時,供體微珠與受體微珠也隨之被拉近,在 680 nm 雷射光激發下,供體微珠所發出的能量即可促使鄰近的受體微珠產生 615 nm 訊號。
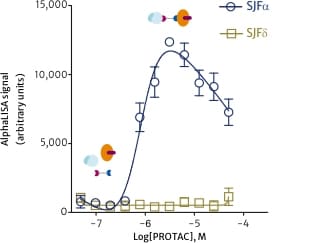
IMAGE © Nat Commun. 2019 Jan 10;10(1):131. Fig. 3b [5]. 從 AlphaLISA® 實驗結果來看,的確僅有 SJFα 這款 PROTAC 藥物能夠與 p38α 及 VBC 有效形成三元複合物,SJFδ 則否。後續的 HeLa 細胞實驗也再次佐證了 AlphaLISA® 與先前 WB 的實驗結果,在 HeLa 細胞實驗中唯有 SJFα 處理的細胞才能在細胞溶解物中偵測到泛素化的 p38α 存在,SJFδ 處理細胞則否。Craig M. Crews 團隊的研究發現對未來蛋白質異構物專一性 PROTAC 藥物的設計與發展極具啟發性 [5]。 更多 PROTACs 藥物開發相關應用產品資訊,歡迎洽詢 Revvity 台灣代理 — 伯森生技。您可透過下方連結瀏覽更多相關資訊與活動訊息:
References
|
|

|
 |
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]