|
看 Alpha 技術如何助力新型藥物傳輸系統研究 - 以開發蛋白質藥物傳輸用益生菌為例 目前市面上絕大多數的蛋白質藥物仍是採用「注射」方式進入人體,由於蛋白質在血液中並不穩定,因此為了確保達到有效用藥濃度,往往必須提高注射劑量。如此一來不僅增加藥物成本,也容易導致副作用的產生,使病人感到不適。美國 Tenza 公司試著利用在優格、康普茶等發酵食品中常見的益生菌,將其改造為能夠生產蛋白質藥物的菌株,使藥物可以更簡易有效的方式進入人體,並直接在目標組織中發揮作用。
© Tenza, Inc. 為了評估菌株的改造效果,就需要一種檢測方式來定量各個不同菌株的活性蛋白質藥物產量 ELISA 是傳統使用的檢測方式,然而 Tenza 研發團隊考量到 ELISA 每個反應的樣本需求量較大,還有偵測區間較窄、需要多次 Wash 步驟等種種不利於高通量篩選的因素,最終決定使用 Revvity 所開發的 AlphaLISA 技術來進行檢測。AlphaLISA 不僅能夠節省樣本用量,還可以耐受成分高度複雜的樣本,即使是分泌至培養菌液中的活性藥物也能精確測得。以下就帶您快速了解 AlphaLISA 技術,同時一窺 Tenza 如何優化 AlphaLISA 偵測平台,以更高效經濟的方式找出潛力菌株。
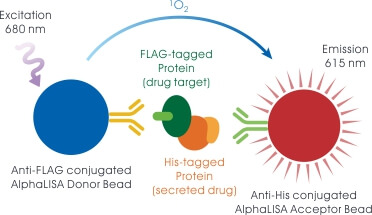
AlphaLISA 的偵測原理與步驟簡單來說就是「只需混合無需洗滌的 ELISA」。以此次 Tenza 公司的研究專案為例,經過基因改良過的菌株會分泌製造出帶有生物活性的蛋白質藥物 (His-tagged protein - secreted drug),它能透過與目標蛋白質 (FLAG-tagged protein - drug target) 結合發揮療效。在 AlphaLISA 反應中,當蛋白質藥物與目標蛋白質結合時,鍵結有專一性抗體的 AlphaLISA 供體微珠 (Donor bead) 與受體微珠 (Acceptor bead) 也隨即被拉近。在 680 nm 雷射光激發下,供體微珠表面所帶有的光敏感物質會催化周遭的氧分子形成活化態的單態氧,並進一步將能量傳遞給鄰近結合的受體微珠,最終產生 615 nm 化學冷光。菌株分泌出的活性蛋白質藥物產量越高,AlphaLISA 訊號強度也就愈強,透過快速簡易的 AlphaLISA 檢測流程,研發團隊即可迅速大量地篩選出活性藥物產量最佳的菌株。 相較於 ELISA,AlphaLISA 具有訊號放大、不需清洗分離步驟、偵測區間更廣 (較傳統 ELISA 增加 10~100 倍) 等優勢。您可以透過〈Alpha 生物分子檢測平台中文目錄〉了解更多 Alpha 技術特性與應用實例。
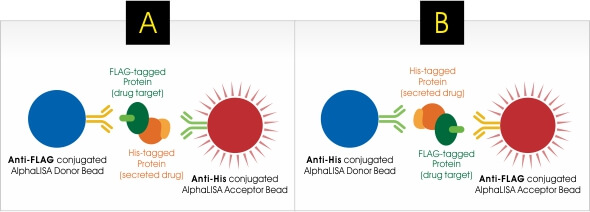
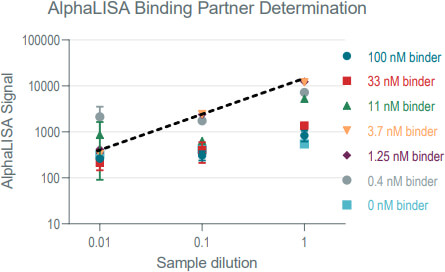
一﹑測試最佳的 AlphaLISA 微珠組合型式:下圖兩種 AlphaLISA 微珠組合均可以用來檢測菌液中能夠與目標蛋白質結合的活性藥物含量,分別是使用 Anti-FLAG 供體微珠加 Anti-His 受體微珠的【組合 A】,和 Anti-His 供體微珠加 Anti-FLAG 受體微珠的【組合 B】。Tenza 團隊對這兩種組合都進行了測試,以了解哪種微珠組合型式效能更佳。
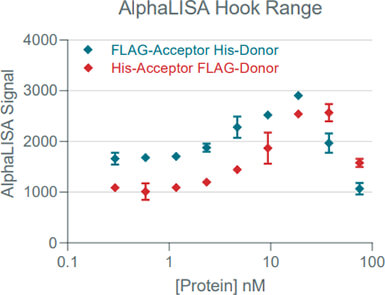
Tenza 團隊根據對藥物與目標蛋白質結合親和力的了解,選擇以 2.5 nM 固定濃度的目標蛋白質搭配不同濃度的純化藥物進行微珠組合測試。測試結果顯示【組合 A:Anti-FLAG 供體微珠 + Anti-His 受體微珠】具有比【組合 B:Anti-His 供體微珠 + Anti-FLAG 受體微珠】更佳的訊噪比 (圖 1) 。
圖 1﹑AlphaLISA 微珠組合測試結果 二﹑優化目標蛋白質用量與菌液樣本稀釋倍率:在選定使用 A 款 AlphaLISA 微珠組合後,Tenza 團隊進一步對 AlphaLISA 反應中的目標蛋白質用量與樣本稀釋倍率進行了優化。他們先使用 ELISA 選出一株具有高藥物產量的菌株作為測試樣本,再以 AlphaLISA 測試 7 種不同目標蛋白質濃度與 3 種不同菌液稀釋倍率。圖 2 結果顯示在低目標蛋白質濃度下可以得到較高的 Alpha 訊號,高濃度的目標蛋白質則會導致鉤狀效應 (hook effect) 使 Alpha 訊號降低,最終決定以 2 nM 作為目標蛋白質用量。除此之外,在樣本稀釋 10 倍的狀況下,可以給高藥物濃度的樣本留下更多檢測空間,也能在不犧牲檢測結果的情況下更好地降低細胞培養基的背景干擾。
圖 2﹑目標蛋白質用量與菌液樣本稀釋倍率測試結果
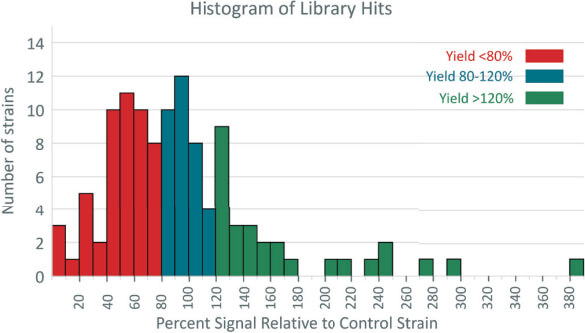
圖 3﹑以 AlphaLISA 篩選出多個高藥物產量潛力菌株 在完成優化後,Tenza 團隊以 AlphaLISA 檢測了 112 個改良菌株與一個已知藥物產量的參照菌株。AlphaLISA 檢測結果如同 Tenza 團隊所預期的,有三成左右 (34/112) 的改良菌株其藥物產量和參照菌株落差在上下 20% 以內,有超過四成 (50/112) 的改良菌株產量不到參照菌株的 80%,然而也有四分之一 (28/112) 的改良菌株藥物產量高於參照菌株 1.2 倍以上,甚至有些菌株產量達到了參照菌株的 3~4 倍之多,其結果也在後續的 ELISA 確效實驗中獲得了證實。 透過 Tenza 團隊的研發專案,證實只需要幾個簡易的優化步驟就能利用現成的【Alpha Toolbox Beads】迅速開發出一個強大的生物分子檢測平台。相較於步驟繁瑣的傳統 ELISA,完全不需要 wash 的 AlphaLISA 不僅更適合高通量篩選實驗,高靈敏度與寬廣偵測區間的特性也使其更能有效識別出潛力藥物 (或菌株)。若您有興趣深入了解如何將 Alpha 技術應用在您的研究中,歡迎洽詢 Revvity 台灣代理伯森生技。您可透過下方連結瀏覽更多相關資訊: |
|||||

|
 |
||||
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]