 |
|
細胞免疫螢光染色沒有訊號或背景值過高?18 個實用小撇步帶你遠離醜圖
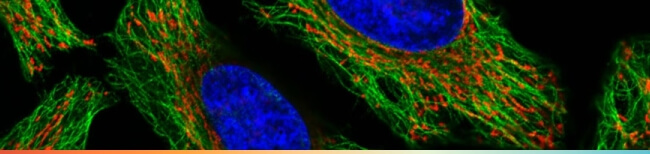
大家在做細胞免疫螢光染色 (ICC/IF) 的時候,應該都想要拍到美美的結果圖吧?然而理想很豐滿,現實卻往往很骨感。你心目中的圖片可能是這樣的…
點擊圖片觀看圖片來源
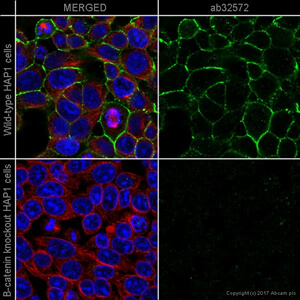
但實際上你的圖片可能是這樣

圖 A
或是這樣…
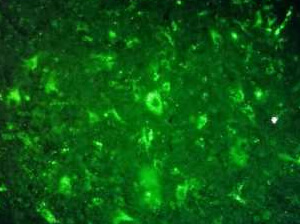
圖 B
想要擺脫醜圖,快來試試以下幾個 Abcam 研發團隊的小撇步吧!
如果在螢光顯微鏡下幾乎看不到目標螢光訊號,或是僅有幾個散佈的微弱螢光點,可以從以下幾個方面進行排查:
|
ICC/IF 無訊號或訊號弱
|
|
可能原因
|
解決方案
|
目標蛋白質於樣本中不表現或表現量過低 |
|
目標蛋白質位於細胞內,抗體無法有效進入細胞反應 |
- 使用甲醇 (Methanol) 或丙酮 (Acetone) 作為固定液,可同時對細胞打洞
- 使用甲醛 (Formaldehyde) 或福馬林類固定液時,需額外以 0.1–0.25% Triton X-100 對細胞膜進行打洞處理;Triton X-100 含量百分比需進行測試與優化
- 適當延長細胞打洞處理時間
|
樣本固定方法不當,破壞目標蛋白質的抗原表位 (Epitope) |
|
樣本儲存時間過長 |
|
抗體無效或失效 |
|
抗體濃度過低 |
- 增加一抗/二抗的工作濃度,或透過序列稀釋測試抗體最佳工作濃度 [抗體稀釋指南]
- 建議於 4°C 避光孵育一級抗體一整晚
|
二級抗體無法辨識一級抗體 |
- 確認已正確選用與一級抗體相匹配的二級抗體,例如使用兔單株抗體作為一抗時,應選用抗兔子的二抗 [抗體選擇指南]
|
螢光訊號淬滅 |
|
螢光顯微鏡濾片選擇不合適 |
|
如果在螢光顯微鏡下看到成片的螢光亮點,通常是樣本、器皿的自發性螢光或是螢光標定抗體非專一性結合所導致。針對這類背景值過高的狀況,我們可以從以下幾個方面進行排查:
|
ICC/IF 高背景值
|
|
可能原因
|
解決方案
|
自發性螢光 |
- 改用低自發螢光材質製造的器皿
- 設置未染色的樣本作為對照組,以確認樣本本身的自發螢光程度
- 細胞在藍色波長的自發螢光較高,應避免使用藍色螢光標定抗體檢測低豐度蛋白質
- 舊的甲醛溶液容易產生自發螢光,建議改用新鮮配製的甲醛固定液
- 固定後應充分洗滌樣本,避免固定液殘留
- 在阻斷液中添加終濃度為 0.3 mol/L 的 Glycine,或改用非醛類固定液
|
樣本變乾 |
|
目標訊號過弱 |
- 改用更亮的螢光染料
- 實驗條件允許下,提高樣本中的目標蛋白質表現量,例如以藥物或特定條件誘導處理細胞,促使目標蛋白質表現量增加
|
阻斷不充分或未使用適合的阻斷液 |
- 適當延長阻斷時間
- 更換阻斷液,推薦使用二抗宿主血清作為阻斷液,例如二抗是 Goat Anti-Rabbit IgG 時,使用 Goat serum 作為阻斷液
|
抗體濃度過高 |
- 適當降低抗體濃度,或透過序列稀釋測試抗體最佳工作濃度 [抗體稀釋指南]
|
一級抗體非專一性結合 |
|
二級抗體非專一性結合 |
- 設置不放一抗、只孵育二抗的對照組,以確認二抗專一性
- 改使用具有高度專一性的預吸附二級抗體
|
清洗不足 |
- 在 Wash buffer 中加入 Tween-20,並適當增加沖洗時間與次數
|
訊號光譜重疊 (多重染色) |
- 調整顯微鏡設置,一次只接收一種螢光染料訊號
- 盡量選擇沒有光譜重疊的螢光染料
|
除了以上兩種情形,您是否還有其他細胞免疫螢光染色的實驗困擾呢?歡迎洽詢 Abcam 台灣代理伯森生技取得個人化的技術支援服務。您可透過下方連結瀏覽更多相關資訊:
|
 |
 |
|
|
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]


|





