|
Western Blot 實驗做不出來?讓 Abcam Checklist 協助你一一排除問題 西方墨點法 (Western Blot, 以下簡稱 WB) 是最常使用的實驗技術之一,實驗流程主要包含樣本製備 (Sample Preparation)、電泳分離 (Electrophoresis)、轉漬 (Transfer)、阻斷 (Blocking)、抗體反應 (Antibody Incubation) 與訊號偵測 (Signal Detection)。這六大步驟環環相扣,稍有疏忽就可能導致實驗結果不佳,甚至一無所獲。為了協助您能取得良好的 WB 實驗結果,Abcam 特別提供便捷的【Western Blot 實驗檢查清單】供您下載使用。清單中列出 WB 每個實驗步驟需要特別注意的實驗細節、操作條件,透過這份清單您可以檢視是否遺漏了哪些關鍵點。或者,您也可以透過以下內容了解 WB 的實驗注意事項。
1. 樣本製備 (Sample Preparation) 1.1 了解目標蛋白,選擇正確的樣本。在實驗開始前,請務必透徹了解目標蛋白質的特性,例如:會在哪些組織或細胞中表現?是在細胞膜、細胞質還是細胞核中?是否表現量低微,需要誘導 (induction) 才能偵測得到?是否具有轉譯後修飾 (post-translational modification, PTM)?是否存在有其他異構物 (isoforms)?是否會形成二聚體 (dimer) 或多聚體 (polymer) 等四級結構?以及是否特別不穩定,容易降解? 當您充分掌握目標蛋白質的資訊,便能選擇正確的樣本、制定適合的樣本製備方案、合理解讀實驗結果。以下為您列舉出三個典型案例:
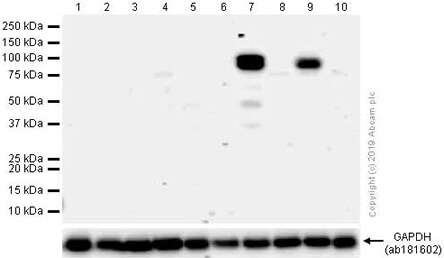
MMP9 蛋白質在各種不同細胞株中的表現量差異懸殊。 🧪 實驗材料:〈一級抗體〉Anti-MMP9 antibody [EP1255Y] (ab137867);〈Lane 1 樣本〉LoVo;〈Lane 2 樣本〉Huh7;〈Lane 3 樣本〉MCF7;〈Lane 4 樣本〉HeLa;〈Lane 5 樣本〉Caco-2;〈Lane 6 樣本〉A549, serum starved overnight;〈Lane 7 樣本〉A549, serum starved overnight, then treated with 80nM TPA for 24 hours;〈Lane 8 樣本〉MDA-MB-231, serum starved overnight;〈Lane 9 樣本〉MDA-MB-231, serum starved overnight, then treated with 200nM TPA for 24 hours;〈Lane 10 樣本〉HepG2。
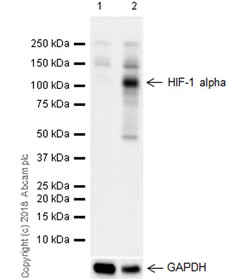
HIF-1 alpha 蛋白質在大鼠神經膠質瘤細胞中需經過低氧誘導才表達。 🧪 實驗材料:〈一級抗體〉Anti-HIF-1 alpha antibody [EPR16897] (ab179483);〈Lane 1 樣本〉Untreated C6 (rat glial tumor glial cell);〈Lane 2 樣本〉C6 treated with 400 µM CoCl₂ and 20 µM MG-132 (ab141003) for 4 hours。
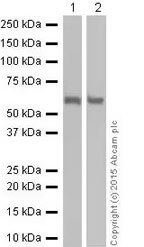
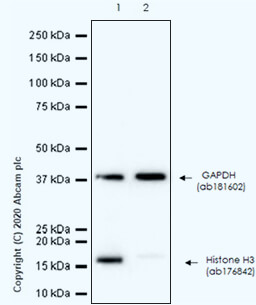
SQSTM1 / p62 蛋白質預期分子量為 47 kDa,但由於轉譯後修飾,最終 WB 實驗偵測到的條帶分子量為 62 kDa。 🧪 實驗材料:〈一級抗體〉Anti-SQSTM1 / p62 antibody [EPR18351] (ab207305);〈Lane 1 樣本〉HepG2;〈Lane 2 樣本〉HeLa。 1.2 樣本製備注意事項。樣本製備是 WB 實驗的開端,裂解緩衝液 (lysis buffer) 的選擇、樣本的裂解方式與溫度等變性條件的控制,都會影響到樣本製備的成功與否。以下是 Abcam 團隊根據多年經驗所整理出的樣本製備注意事項,包含:
2. 電泳分離 (Electrophoresis) 2.1 選用合適的蛋白質樣本變性 (Denature) 條件。一般實驗流程是使用 95°C 加熱或煮沸 5 分鐘,使蛋白質變性。然而對於有些多重跨膜蛋白 (multipass transmembrane proteins),建議使用 37℃ 或 70℃ 加熱 10 分鐘,能達到更好的蛋白質變性效果。 2.2 選用合適的電泳膠體濃度。電泳膠體的濃度,對於不同分子量的蛋白質具有不同的分離效果。您可參照下表,根據目標蛋白質的分子量選擇適合的電泳膠體濃度。
2.3 確保蛋白質樣本上樣量 (Loading) 充足。上樣量會影響到實驗最終是否能檢測到有效訊號、取得良好的成果。建議每個膠體孔槽 (well) 中注入至少 20 μg 總蛋白 (total protein) 樣本進行電泳。 2.4 設立實驗對照組 (Control)。務必設立陽性對照組 (Positive Control)(可參閱抗體說明書上所標示的陽性對照樣本)與陰性對照組 (Negative Control)(例如使用不會表現目標蛋白的細胞作為陰性對照樣本,以排除偽陽性結果)。Abcam【Knockout Cell Lysates】系列產品即是非常便利的選擇,它是 CRISPR/Cas9 基因剔除癌細胞株的細胞溶解物,可作為 WB 陰性對照組使用;同時可依需求隨附 Wild-type Lysates,作為 WB 陽性對照組。 除此之外,建議偵測 Loading Controls 以校正 Well 與 Well 之間、膠片與膠片之間樣本量的誤差。選擇 Loading Controls 時,應選擇與目標蛋白質分子量不同(以避免偵測結果互相干擾)且能在樣本中連續穩定表達的蛋白質。您可參照下表選擇合適的 Loading Controls,或參閱【Loading Controls 抗體產品目錄】取得相關產品資訊。
3. 轉漬 (Transfer) 3.1 依據目標蛋白分子量大小調整轉漬緩衝液的 SDS 與甲醇 (Methanol) 濃度。目標蛋白質分子量大於 100 kDa 時,建議於轉漬緩衝液中添加 SDS(終濃度 0.1%),並將甲醇濃度控制在 10% 以下,以提高轉漬效率。目標蛋白質分子量小於 100 kDa 時,建議轉漬緩衝液中含 20% 甲醇。
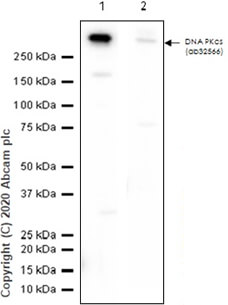
透過檢測 HeLa 細胞溶解物中的 DNA PKcs 表現量,觀察轉漬緩衝液中的甲醇含量對轉漬效率的影響。 🧪 實驗材料:〈一級抗體〉Anti-DNA PKcs antibody [Y393] (ab32566);〈Lane 1〉轉漬緩衝液中含 10% 甲醇;〈Lane 2〉轉漬緩衝液中含 20% 甲醇。 3.2 選用合適的 PVDF 轉漬膜。目標蛋白質分子量小於 10 kDa 時,建議使用 0.2 μm 孔徑的 PVDF 轉漬膜。若最終偵測訊號為螢光型式,建議選用低螢光背景值 PVDF 轉漬膜 (ab133411)。 3.3 操作細節。經過甲醇活化完成後的 PVDF 轉漬膜需充分清洗,避免甲醇殘留於表面。轉漬開始前,務必確認轉漬膜與膠體間平整無氣泡。 3.4 檢視轉漬效率。轉漬完成後建議可以使用【麗春紅染劑 (Ponceau S Solution)】對轉漬膜進行染色,以確認轉漬效率。 ⚠ 若最終偵測訊號為螢光型式,請於檢視完轉漬效率後確保轉漬膜上的麗春紅染劑被充分洗淨。
使用麗春紅染色判斷轉漬實驗是否成功。 🧪 實驗材料:〈麗春紅染劑〉Ponceau S Solution (ab270042);〈左圖〉轉漬成功;〈右圖〉轉漬失敗。 4. 阻斷 (Blocking) 沒有適用所有實驗的阻斷液 (blocking buffer)。阻斷液的阻斷效果,會因不同的實驗樣本、目標蛋白而產生差異。因此建議您先進行測試,以挑選出最適合您實驗的阻斷液。
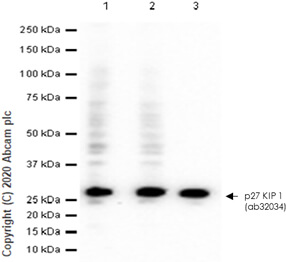
透過檢測 MCF7 細胞溶解物中的 p27 KIP 1 表現量,可觀察到不同阻斷液的阻斷效果不同。 🧪 實驗材料:〈一級抗體〉Anti-p27 KIP 1 antibody [Y236] (ab32034);〈Lane 1〉阻斷液為 2% BSA;〈Lane 2〉阻斷液為 5% BSA;〈Lane 3〉阻斷液為 5% NFDM/TBST。 5. 抗體反應 (Antibody Incubation) 抗體反應通常包含一級抗體與二級抗體反應,一級抗體可專一性地辨識目標蛋白質,二級抗體則能辨識一級抗體,具有放大訊號的作用。在進行抗體反應時,Abcam 團隊會注意以下事項:
6. 訊號偵測 (Signal Detection) 化學冷光訊號檢測注意事項:
螢光訊號檢測注意事項:
更多 WB 技術資源 以上就是 Abcam 團隊在進行 WB 實驗時會特別關注的一些小細節。在您進行日常的 WB 實驗時,歡迎下載使用【Western Blot 實驗檢查清單】,方便您隨時檢查是否遺漏了哪些關鍵點!任何 WB 疑難雜症,也歡迎直接洽詢 Abcam 台灣代理 — 伯森生技,我們將針對您正遭遇的問題提供技術支援與建議。您可透過下方連結瀏覽更多 WB 技術資源與相關資訊: |
|||||||||||||||||||||||||

|
 |
||||||||||||||||||||||||
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]