|
新冠病毒研發應用產品特輯 (二) 老藥新用與抗病毒藥物篩選 新型冠狀病毒 (SARS-CoV-2) 所引發的 COVID-19 武漢肺炎疫情持續在全球升溫,本期報導將藉由近期發表文獻與您分享新藥開發技術領導品牌 Revvity 如何透過生物分子檢測技術與高通量檢測設備協助進行新冠病毒的藥物重新定位 (drug repurposing) 與抗病毒藥物篩選。 | |
以 AlphaLISA® 技術協助藥物重新定位,快速篩選出能夠阻斷 SARS-CoV-2 進入細胞的潛力小分子藥物或生物製劑 |
|
|
SARS-CoV-2 是利用病毒顆粒表面的棘蛋白 (spike protein, S protein) 與人體細胞表面受體蛋白 ACE2 (angiotensin-converting enzyme 2) 結合,使病毒能夠進入細胞造成感染。若能有效阻斷棘蛋白與 ACE2 受體間的蛋白質交互作用,將可望達到治療效果。為因應國際社會對 SARS-CoV-2 治療藥物的急迫需求,美國國家先進轉譯科學中心 (National Center for Advancing Translational Sciences, NCATS) Quinlin M. Hanson 等人建立了 AlphaLISA® 藥物篩選平台以進行藥物重新定位。在 3,384 個已通過核准的小分子藥物與生物製劑 (biologics) 臨床藥物中,作者成功篩選出 25 個具有阻斷棘蛋白與 ACE2 受體結合活性的潛力藥物,雖然最終僅有 Corilagin 這個藥物通過確校驗證,然而作者表示 AlphaLISA® 技術平台所具有的多項優勢特點,例如高訊噪比、高穩定度(1536 孔微量盤的 AlphaLISA 分析實驗平均 Z 值 >0.77)、高適用性(可同時適用於化合物、奈米粒子、胜肽等小分子與大分子藥物篩選)與高度彈性(可依據實驗需求彈性更換研究標靶),都使得 AlphaLISA® 成為 SARS-CoV-2 抗病毒治療藥物開發的有效工具 [1]。
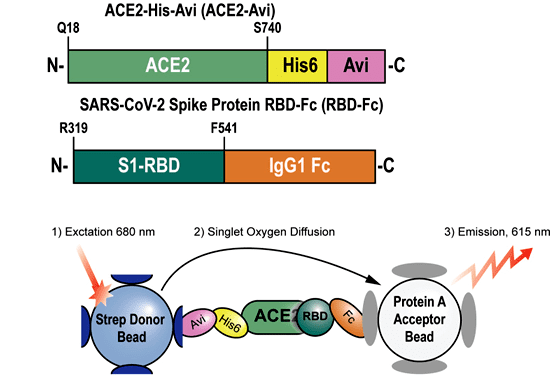
圖 1﹑AlphaLISA RBD−ACE2 藥物篩選平台檢測原理圖示。作者使用 SARS-CoV-2 棘蛋白序列中能夠與 ACE2 作用結合的受體結合區域 (receptor binding domain, RBD) 代表棘蛋白。人類 ACE2 受體(融合有 biotinylated AviTag)與病毒 RBD(融合有 Fc tag)可分別被標定有 Streptavidin 的 Alpha 供體微珠 (donor bead) 與標定有 Protein A 的 Alpha 受體微珠 (acceptor bead) 所捕獲。當 RBD 與 ACE2 兩者結合時,供體微珠與受體微珠間的距離隨即被拉近,在 680 nm 雷射光激發下,供體微珠表面所帶有的光敏感物質會催化周遭的氧分子形成活化態的單態氧 (singlet oxygen),並進一步將能量傳遞給鄰近的受體微珠產生 615 nm 訊號。若待測藥物能影響 RBD 與 ACE2 兩者間的交互作用,就會造成 Alpha 訊號下降,最終可藉由 IC₅₀ 數值判斷藥物的抑制能力,篩選出候選藥物進行後續確效試驗。 IMAGE © ACS Pharmacol Transl Sci. 2020 Nov 17;3(6):1352-1360. Figure 1 [1]. |
|
結合蛋白質結構分析、電腦虛擬篩選與高通量酵素活性檢測三種策略以進行藥物重新定位,找尋出能夠抑制 SARS-CoV-2 主蛋白酶 (Mpro) 的潛力藥物 |
|
|
上海科技大學楊海濤教授與清華大學饒子和教授合作團隊同樣希望藉由藥物重新定位,從舊藥中篩選找出可能的 SARS-CoV-2 抗病毒治療藥物。他們所選擇的藥物標靶是 SARS-CoV-2 主蛋白酶 (main protease, Mpro)。Mpro 會在 SARS-CoV-2 進入細胞後表現,主要功能是用來切割 SARS-CoV-2 複製酶 (replicase) 基因所表現出的兩條長片段多聚蛋白 "pp1a" 與 "pp1ab",使其形成多個功能蛋白質執行病毒核酸複製與轉錄工作。由於 Mpro 在病毒生命週期中擔負著極為關鍵的角色,且在人體內並無相似分子,因此是非常好的抗病毒藥物設計標靶。 根據饒子和研究團隊在 2005 年的研究成果,他們發現不同冠狀病毒的 Mpro 雖然序列相似度不高,但是在 Mpro 受質結合區域 (substrate-binding pocket) 卻存在著高度保留的立體結構。因此楊海濤與饒子和合作團隊首先想到的就是當時所找出的通用於多種冠狀病毒的 Mpro 抑制化合物 "N3" 是否也同樣適用於 SARS-CoV-2 Mpro?根據 SARS-CoV-2 Mpro 與 N3 複合體的晶體結構解析結果,他們發現 N3 的確可以穩定地嵌合在 SARS-CoV-2 Mpro 的受質結合區域內。
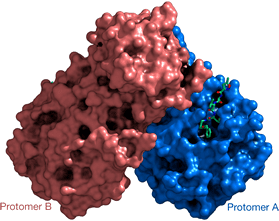
圖 2﹑ SARS-CoV-2 Mpro 與 N3 複合體的晶體結構。N3(綠色)嵌合於 SARS-CoV-2 Mpro 的受質結合區域內。藍色代表 SARS-CoV-2 Mpro 的 A 單元體 (Protomer A),鮭魚粉代表 SARS-CoV-2 Mpro 的 B 單元體 (Protomer B)。 IMAGE © Nature. 2020 Jun;582(7811):289-293. Fig. 1b [2]. 接著他們進一步將此複合體結構資訊應用於電腦虛擬篩選,找出一個同樣能緊密嵌合於 SARS-CoV-2 Mpro 受質結合區域的化合物 "Cinanserin"。同時他們也利用酵素活性分析試驗高通量篩選 10,000 個現有的臨床/臨床前期測試藥物與天然產物。酵素活性分析試驗作用原理是利用一段可被 SARS-CoV-2 Mpro 辨識切割的胜肽作為反應受質,該胜肽同時含有螢光分子 Mca 以及熄光分子 (quencher) Dnp。當該胜肽被 SARS-CoV-2 Mpro 切割水解後,即可在 320 nm 激發下發射出 405 nm 螢光訊號。若待測藥物能夠抑制 SARS-CoV-2 Mpro,就會造成螢光訊號下降。作者使用 EnVision® 多功能微量盤檢測儀進行螢光訊號檢測,最終篩選出 6 個具有抑制活性的藥物,其中 "Ebselen" 表現最佳。後續的細胞實驗也證實 Ebselen 具有比 N3 與 Cinanserin 更佳的抗病毒效果,同時根據動物實驗與人類臨床測試紀錄,Ebselen 是個毒性極低的安全藥物,顯示 Ebselen 具有發展為 SARS-CoV-2 治療藥物的強大潛力。此重大發現已於 2020 年 4 月線上發表於《Nature》期刊 [2]。
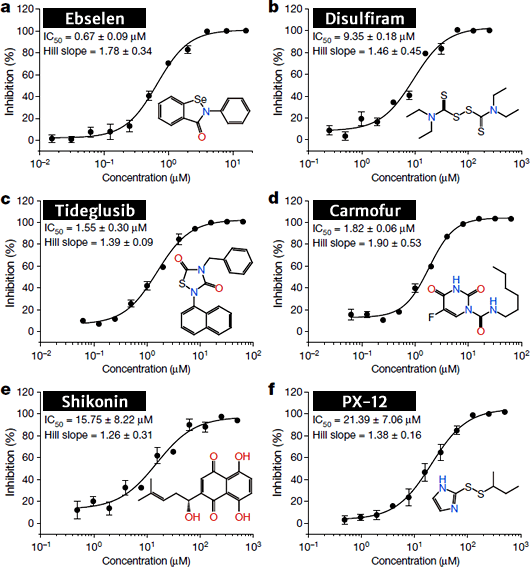
圖 3﹑以酵素活性分析試驗自 10,000 個舊有藥物中篩選出 6 個具有抑制 SARS-CoV-2 Mpro 活性的藥物,其中 "Ebselen" 表現最佳,IC₅₀ 數值為 0.67 μM。 IMAGE © Nature. 2020 Jun;582(7811):289-293. Fig. 3 [2]. |
|
|
更多病毒研究相關產品資訊與技術應用實例,歡迎洽詢 Revvity 台灣代理 — 伯森生技。您可透過下方連結瀏覽更多相關資訊:
References
|
|

|
 |
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]